تصویربرداری اسکن توموگرافی کامپیوتری پرفیوژن در تمایز خوش خیم از بدخیم ضایعات پاروتید
شایع ترین محل تومورهای غدد بزاقی، غده پاروتید است. توموگرافی کامپیوتری (CT)، تصویربرداری رزونانس مغناطیسی (MRI) و سونوگرافی روش های تصویربرداری برای افتراق تومورهای خوش خیم از بدخیم ضایعات پاروتید هستند. هدف این مطالعه ارزیابی ارزش تشخیصی سی تی پرفیوژن می باشد برای افتراق طبقه بندی بافت شناسی تومورهای خوش خیم و بدخیم پاروتید. MethodsA در مجموع 29 بیمار مبتلا به نئوپلاسم پاروتید در این مطالعه وارد شدند. منظور داشت سن و همه متغیرهای پرفیوژن CT ( گرادیان و نفوذپذیری، جریان خون [BF]، حجم خون [BV]، میانگین زمان عبور [MTT]، سطح نفوذپذیری [PS]، حداکثر شدت طرح ریزی [MIP]، منحنی چگالی زمان [TDC]، و زمان تا اوج [TTP]) بین سه مورد مقایسه شد. گروه ها (تومورهای بدخیم [MTs]، تومور Warthin [WT] و آدنوم پلئومورفیک [PA]). یافته ها: میانگین سنی بیماران 55.9 14.1 (26-77) بود و 15 نفر از آنها مرد (51.7%). یازده ضایعه PA [37.9٪]، 8 ضایعه WTs بودند (27.6٪ 0 و 10 ضایعات (34.5%) MTs (6 کارسینوم سلول آسینیک [ACCs]، 3 کارسینوم آدنوسیستیک بودند. [AdCCs]، و 1 کارسینوم موکواپیدرموئید [MEC]). میانگین سنی بیماران مبتلا به WTs 62 7.5 سال بود. 52 14.2 برای بیماران مبتلا به پاس، و 55.2 17.2 برای بیماران مبتلا به MTs (p ¼ 0.32) . میانگین MIP در WT 122.7 12.2 بود، در حالی که در PA 80.5 19.5 بود. و 76.2 27.1 در MTs (p <0.001). میانگین MIP برای WT بیشتر از PAs و MTs; مقادیر MT و PA از نظر آماری متفاوت نبود. میانگین BF، BV، و اوج منحنی در WTs در مقایسه با دو گروه دیگر و منحنی بالاتر بود زمان 2 و TTP در PA در مقایسه با MT ها بالاتر بود.
نتیجه گیری بر اساس این مطالعه، سی تی پرفیوژن غده پاروتید و پارامترهای آن انجام شد می تواند توده های پاروتید خوش خیم و بدخیم را تشخیص دهد.
معرفی
نئوپلاسم های غدد بزاقی نسبتاً نادر هستند و 2 تا را تشکیل می دهند 6.5 درصد تومورهای سر و گردن. 1 ضایعات بدخیم به طور معمول پس از سن 60 سالگی، در حالی که ضایعات خوش خیم وجود دارد معمولا زمانی که بیماران بالای 40 سال هستند ظاهر می شود. نئوپلاسم های خوش خیم در بین زنان بارزتر است نسبت به مردان، اما تومورهای بدخیم به طور مساوی توزیع می شوند بین دو جنس.2 شایع ترین نئوپلاسم خوش خیم غده پاروتید آدنوم پلئومورفیک (PA) است که 60٪ را نشان می دهد. از تمام نئوپلاسم های پاروتید تومور وارتین (WT) دومین مورد است شایع ترین تومور خوش خیم، با بروز 15 تا 20 درصد از همه تومورهای پاروتید تومورهای بدخیم (MTs) پاروتید غده نادر است و بروز 2 تا 3 مورد در هر 100000 نفر بر اساس شواهد، 20 تا 30 درصد از تومورهای غده پاروتید، 40 درصد زیر فکی، 50 درصد از غدد بزاقی کوچک و 90 درصد تومورهای زیر زبانی هستند ضایعات بدخیم شایع ترین تومور بدخیم از پاروتید کارسینوم موکواپیدرموئید است. بدخیم دیگر ضایعات عبارتند از: کارسینوم کیستیک آدنوئید، سرطان سلول سنگفرشی نوما، و آدنوکارسینوما.3 تست های تصویربرداری برخی اطلاعات مانند مکان را نشان می دهد (تومورهای خارج کپسولی یا داخل کپسولی)، سطحی و تومورهای لوب عمیق، عصب صورت و ساختارهای مجاور، گسترش تومور، درگیری عصبی و گره متاستازها توموگرافی کامپیوتری و MRI به طور معمول استفاده می شود ارزیابی تومورهای سر و گردن به طور کلی، تومورهای خوش خیم هستند همگن تر، با حاشیه های قابل مشاهده و بدخیم تر ضایعات دارای حاشیه نامرئی و ظاهر ناهمگن هستند. ance بیوپسی از ضایعات مشکوک یک گام ضروری است تشخیص را تایید کنید سی تی اسکن پرفیوژن اخیرا انجام شده است به عنوان یک روش جدید برای تجسم نئوواسکولاریزاسیون ارائه شده است، که یکی از مشخصه هاست
ویژگی های بدخیم تومورهایی که اجازه می دهد تا با سرعت سریع رشد کنند سی تی پرفیوژن ارزیابی عملکرد را تسهیل می کند پارامترهای موجود در نئوپلاسم های غدد بزاقی، مانند بافت پرفیوژن؛ علاوه بر این، می تواند اطلاعات مورفولوژیکی را جمع آوری کندکه یک سی تی اسکن معمولی قادر به ارائه آن نیست. سی تی پرفیوژن تراکم میکروواسکولار و نفوذپذیری عروق را اندازه گیری می کند با پارامترهای مختلف؛ جریان خون (جریان خون)، که حجم خون عبوری از بافت را اندازه گیری می کند در طول اولین گذر؛ میانگین زمان حمل و نقل (MTT) مطابقت دارد به میانگین زمان، در ثانیه، گلبول های قرمز می رسد صرف حجم مشخصی از گردش خون مویرگی. حجم خون، که حجم خون عبوری به بافت هدف؛ نفوذپذیری بافت، و در نهایت، زمان مدلهای منحنی چگالی که بر اساس زمان محاسبه میشوند نسبت شستشوی اوج (TTP) (WR). در تومورهای سر و گردن، یافته های سی تی اسکن پرفیوژن هستند بر اساس افزایش کنتراست استاندارد در اسکن های مارپیچ، که برای دسته بندی مورفولوژیک و انکولوژیک استفاده می شوند خصوصیات.5،6 سی تی پرفیوژن می تواند نکروز و بافت های طبیعی را متمایز کند در تومورهای بزرگ این روش واکنشی یا متا را تجسم می کند گره های لنفاوی ساکن با توجه به الگوی اولیه پرفیوژن تومور با سی تی اسکن پرفیوژن در تشخیص و تمایز ضایعات پاروتید؛ جراحان قبل از این بهترین روش را انتخاب می کنند
عمل جراحي.
روش ها
در این مطالعه مقطعی 35 بیمار مراجعه کننده انجام شد به بیمارستان ما با توده پاروتید جامد ناشناخته مراجعه می کند کاندید عمل جراحی پاروتیدکتومی یا بیوپسی بودند ضایعه و پس از امضا در یک مطالعه آینده نگر وارد شدند فرم های رضایت این طرح به تایید کمیته اخلاق رسیده بود در نظر گرفته شد که بیماران محدودیتی ندارند دریافت مواد حاجب محدودیت های سنی و جنسیتی به عنوان معیار ورود در نظر گرفته نشد. تعداد نمونه ها به صورت آماری محاسبه شد و شامل 35 نمونه بود بیماران بستری یا غیر پذیرفته شده با توجه به استثنا معیارهای sion; بیمارانی که آسیب شناسی قطعی داشتند شناسایی شد با جراحی یا نمونه برداری قبلی و کسانی که ندادند اجازه گرفتن بیوپسی یا سی تی اسکن، و همچنین کسانی که به دلیل خطاهای فنی عطر نتوانستند وارد شوند پارامترهای یون سی تی اسکن حذف شدند. همه بیماران ابتدا با سی تی بدون کنتراست معاینه شدند توالی های اسکن توسط رادیولوژیست خبره و حجم تزریق برای پرفیوژن سی تی اسکن با تعیین شد در سی تی اسکن اولیه روی وسیع ترین محل تومور تمرکز کنید. در مجموع 60 میلی لیتر ماده حاجب غیر یونی در محل تزریق شد سرعت 4 تا 6 میلی لیتر در ثانیه توسط انژکتور، تحت نظارت رادیولوژیست، برای انجام سی تی اسکن پرفیوژن. سپس در عرض 5 تا 6 ثانیه پس از شروع تزریق، اسکن انجام شد توسط یک اسکنر سی تی اسکن چند تکه 16 آشکارساز و به دنبال آن گرفته شده است 20 میلی لیتر آب نمک با همان سرعت در تزریق سایت. پس از انجام مرحله اول سی تی اسکن، زیر مراحل بعدی ادامه یافت و از طریق آن تکمیل شد روش معمول سی تی اسکن سفالیک و دهانه رحم (در واقع، فاز پرفیوژن تومور در مراحل اولیه تزریق
به عنوان توالی های اضافی در این نوع سی تی اسکن تصویر می شوند و بقیه مراحل مشابه سی تی اسکن معمولی است). هیچ آلرژی دارویی ثبت نشد و کل اشعه دریافت شد در محدوده استاندارد بود. سپس برای هر بیمار خون حجم (BV)، جریان خون (BF)، نفوذپذیری مویرگی (CP) و TTP بر اساس سی تی اسکن و همچنین زمان محاسبه شد. نمودار منحنی چگالی (TDC) بر اساس TTP و شستشو نسبت توسط نرم افزار استاندارد زیمنس. پارامترهای TTP و WR برای (TDCs) استفاده شد تقسیم منحنی TDC به چهار نوع مختلف تقسیم می شود بر اساس اطلاعات نوع 1 شامل مواردی است که در آنها شیب منحنی به طور مداوم در حال افزایش است و ثابت نیست در یک اوج ثابت در 60 ثانیه، با TTP کمتر از 30 ثانیه. نوع 2 دارای WR > 30 درصد و TDCهایی با TTP کمتر از 30 ثانیه است. نوع 3 شامل مواردی است که TDCها دارای TTP 30 و WR هستند < 30%؛ TDCهای نوع 4 WR ندارند. به آن رسیدند فاز فلات و دارای TTP > 30 ثانیه است. یک محل (3-5 میلی متر مربع) از تومور پاروتید که بیشتر داشت بهبود یافته و نسبتاً همگن بود انتخاب شد- برای اندازه گیری پارامترهای سی تی اسکن پرفیوژن. وقتی که توده ناهمگن بود، بخشی از تومور که داشت Archives International of Otorhinolaryngology جلد. 24 شماره 2/2020 پرفیوژن سی تی اسکن تصویربرداری نیازی و همکاران. 167پیشرفت های بیشتر به عنوان بخشی برای بررسی انتخاب شد- ارزیابی پارامترها یا منطقه مورد علاقه (ROI). معیارهای اندازه گیری پارامترهای مربوط به پرفیوژن سی تی اسکن شریان کاروتید خارجی بود مربوط به استانداردهای موجود نمودارهای شریانی و نمودارهای تومور برای پارامتر TDC به طور جداگانه رسم شد، و BV و BF وارد تومور و همچنین بافت می شوند نرخ نفوذ تومور در مقایسه محاسبه شد به شریان کاروتید خارجی توسط نرم افزار، پس از آن انحراف معیار (SD) به طور جداگانه محاسبه شد برای هر کدام پارامتر. در برخی موارد که سی تی اسکن انجام نشد نتایج صحیح به دلیل خطاهای فنی؛ چنین مواردی بود از مطالعه حذف شدند. به طور کلی، یک بیمار حذف شد به دلیل خطاهای فنی و آرتیفکت حرکتی بیماران مدت کوتاهی پس از سی تی اسکن پیگیری شدند و تحت بیوپسی یا جراحی قرار گرفت. آسیب شناسی بیماران بود پیگیری و جمع آوری شد. پنج بیمار از مطالعه حذف شدند این مطالعه به این دلیل بود که آنها جراحی را انتخاب کردند. در نهایت، بیماران بر اساس هیستوپا طبقه بندی شدند. تومورهای خوش خیم یا بدخیم. در طبقه بندی دیگر – کاتیون، بیماران در هیپو عروقی خوش خیم گروه بندی شدند
(از جمله PA)، تومورهای خوش خیم هیپرواسکولار (از جملهWT و MTs از جمله کارسینوم موکواپیدرموئید). [MEC]، کارسینوم سلول آسینیک [ACC]، و سرطان آدنوسیستیکnoma [AdCC]).
تجزیه و تحلیل های آماری
تمامی تحلیل ها با استفاده از نرم افزار آماری انجام شد SPSS نسخه 22 (SPSS Inc., Chicago, IL, USA). فراوانی و شاخص از پراکندگی محاسبه شد. مقدار p کمتر از 0.05 بود از نظر آماری معنی دار در نظر گرفته شده است. توزیع نرمال بود با آزمون شاپیرو-ویلک و ناپارامتریک بررسی شده است برای تجزیه و تحلیل داده های غیر عادی از آزمون ها استفاده شد.
اندازه نمونه ضایعات پاروتید
برای ارزیابی دقت تشخیصی سی تی اسکن پرفیوژن در تشخیص افتراقی پاروتید خوش خیم و بدخیم تومورها (با 90 درصد دقت در مطالعات مشابه)، یک نمونه اندازه 35 بیمار با توان 80 درصد و 5 درصد محاسبه شد. خطای استاندارد با فرمول زیر:
N¼ (z1-a/2)2 (p) (1-p)/d2
در مجموع 35 بیمار مبتلا به تومور پاروتید وارد مطالعه شدند تشخیص و آسیب شناسی نامشخص در طول دوره زمانی از سال 2017 تا 2018
نتایج
در مجموع 29 بیمار (15 مرد و 14 نفر) وارد مطالعه شدند زنان؛ میانگین سنی 55.9 14.1 سال; محدوده) (26-77). این ضایعه در 48.3 درصد موارد در سمت چپ و در سمت چپ قرار داشت سمت راست در 51.7٪. هیستوپاتولوژی نشان داد که 29 مورد شامل 11 مورد PA (37.9%)، 8 مورد WT (27.6%)، و 10 مورد موارد ضایعات بدخیم (34.5%) (شامل 6 مورد ACC). [20.7٪]. همچنین سه مورد AdCC [10.3٪] و یک مورد وجود داشت مورد MEC [3.4٪]). میانگین سن و همه متغیرهای سی تی پرفیوژن با هم مقایسه شدند. در بین سه گروه پاتولوژیک ذکر شده مقایسه شد. (MTs، WTs و PAs)
میانگین سنی 62 7.5 سال در WT، 52 14.2 در PA و 55.2 17.2 در MT [p ¼ 0.32]. میانگین MIP 122.7 12.2 اینچ بود WT، در حالی که در PA 80.5 19.5 و در MT 76.2 27.1 بود. (p <0.001)؛ میانگین MIP WT بالاتر از PA و MT بود.مقدار MT و PA از نظر آماری متفاوت نیست (◄ جدول 1).
میانگین سایر متغیرهای پرفیوژن CT در بین سه مورد گروه ها در جدول 1 ذکر شده است. میانگین BF، میانگین BV، و اوج در منحنی در WT در مقایسه با دیگری بالاتر هستند دو گروه زمان منحنی 2 و TTP در PA در مقایسه با پسر با MT (► جدول 1).
در نظر گرفتن WT و PA به عنوان تشخیص های خوش خیم در مقابل MTs، ما از تجزیه و تحلیل مشخصه عملکرد گیرنده (ROC) برای آن استفاده کردیم افتراق پاتولوژی های بدخیم از خوش خیم محوطه تحت منحنی های ROC (AUC) محاسبه شد (►شکل 1). در میان
همه متغیرها، بالاترین AUCهای آماری معنی دار بودند برای انحراف استاندارد MIP (AUC ¼ 0.8)، اوج منحنی (AUC ¼ 0.81) و یک متغیر جدید با ضرب در میانگین MIP و انحراف استاندارد MIP (◄ جدول 2).
بر اساس منحنی ROC (◄شکل 1)، ما محاسبه کرده ایم شاخص های تشخیصی برخی از بهترین نقاط برش برای این سه متغیر با فاصله اطمینان 95 درصد (CI) (►جدول 3).
با توجه به نتایج تحلیل واریانس (ANOVA)، میانگین MIP، BF، BV، و قله منحنی نشان دهنده آن است تفاوت بین WT در مقابل سایر آسیب شناسی ها (PAs و MT) از نظر آماری معنی دار هستند. بنابراین، ROC تجزیه و تحلیل می کند برای افتراق WT از دو تشخیص دیگر استفاده شد[►شکل. 2].
در این راستا تمامی متغیرها عالی نشان دادند کارایی برای تمایز WTها (همه AUCها بیشتر بودند از 0.93). اما بهترین متغیر میانگین MIP بود که AUC 0.99 (p <0.001) را نشان داد [►شکل. 2]. بنابراین، این متغیر برای تمایز WT ها انتخاب شد. برش انتخاب شده
نقاط و شاخص های تشخیصی آنها برای این متغیر است در جدول 4 ذکر شده است.
بر اساس تجزیه و تحلیل ROC برای WT، یک نقطه برش 116 برای میانگین MIP (◄شکل 3)، ارزش پیشبینی مثبت 100 وجود دارد برای تعیین WT پس با MIP ضایعات را کنار می گذاریم 116 را به عنوان WT معنی کنید و تجزیه و تحلیل ما را برای تمایز تکرار کنیدبدخیم ناشی از ضایعات خوش خیم در بقیه بیماران، با در نظر گرفتن متغیرهای مطالعه در این شرایط ما حذف کردیم 6 بیمار با MIP میانگین 116; بنابراین، ما 23 بیمار داشتیم، از این میان 10 نفر دارای تومور بدخیم و 13 نفر دارای تومورهای خوش خیم بودند (11 PA و دو نفر WT بودند). دوباره از ROC استفاده کردیم تجزیه و تحلیل برای افتراق تومورهای بدخیم از خوش خیم. که در در این وضعیت بهترین AUCها (مقدار p آنها از نظر آماری بود معنی دار) برای MIP SD و بهترین میانگین MIP نشان داده شد برای MIP SD، TTP، و زمان منحنی 2. یافته های تجزیه و تحلیل ROC آنها در جدول 5 نشان داده شده است.
بر اساس منحنی های ROC این چهار متغیر، ما انتخاب کردیم بهترین نقاط برش برای دیفرانسیل بدخیم از خوش خیم ضایعات نتایج در جدول 6 ذکر شده است. با در نظر گرفتن انواع منحنی، 11 منحنی نزولی داشتیم (37.9%)، که از این میان سه مورد بدخیم (27.3%) بودند. 16 از منحنی ها فلات (55.2٪) بودند که در میان آنها 7 منحنی بودند بدخیم (43.8%); و 2 صعودی (6.9%)، هر دو از
جدول 1 مقایسه همه متغیرهای پرفیوژن توموگرافی کامپیوتری در میان سه تشخیص اصلی پاتولوژیک Warthin’sتومور، آدنوم پلئومورفیک و تومور بدخیمکه خوش خیم بودند (p¼0.49).
ترکیب گروه های مختلف از انواع منحنی برای تشکیل یک متغیر دوگانه و تجزیه و تحلیل از بین آنها در مقابل بدخیمی، معنی دار نبود نتیجه برای این متغیر در افتراق بدخیم از ضایعات خوش خیم وقتی الگوهای نزولی را به عنوان الف در نظر بگیریم نشانگر WT (ترکیب فلات و صعود با هم)، ما یک نتیجه آماری معنی دار را نشان دادیم (001/0 p¼)، و حساسیت و ویژگی به ترتیب 88% و 81% بود. که در علاوه بر این، هنگامی که ما فلات یا منحنی های صعودی را در نظر گرفتیم به عنوان نشانگر ضایعات PA، از نظر آماری با یک نتیجه معنی دار (019/0 p¼) و حساسیت و ویژگی از نوع منحنی برای افتراق ضایعات PA 91% و 56% بود.
شکل 1 منحنی های مشخصه عملکرد گیرنده با حداکثر شدت طرح ریزی (MIP) انحراف استاندارد (SD)، میانگین MIP توسط MIP SD، و قله منحنی برای افتراق ضایعات بدخیم از خوش خیم. به ترتیب. جزئیات برای این تجزیه و تحلیل و تشخیص شاخص ها در جدول 7 ذکر شده است.

بحث
غده پاروتید بزرگترین غده بزاقی در انسان استبدن افتراق ضایعات خوش خیم از بدخیم پاروتید در شرایط خاص بسیار مهم است: 1) زمانی که جراحی برای بیمار به دلیل شرایط فیزیکی غیرممکن است. پیری، یا بیماری های زمینه ای، 2) هنگامی که گسترش تومور نامشخص است، 3) بررسی روش جراحی برای ضایعاتی که به پارافارنژیال گسترش یافته است فضا، 4) در موارد تومورهای بدخیم و زمانی که صورت عصب باید برداشته شود 5) در موارد بزرگ یا ثابت تومورها، و 6) هنگامی که مشکوک به درگیری پوست وجود دارد یا لنفادنوپاتی، و در هنگام برنامه ریزی قبل از عمل تشریح گردن مورد نیاز است.7 در این مطالعه شایع ترین تومور پاروتید PA و بود سپس WT بر خلاف ضایعات بدخیم که داشت پارامترهای هیستوپاتولوژیکی مختلف که با یافته های Knopf.8 میزان موفقیت سی تی اسکن پرفیوژن 97.1 درصد بود که با مطالعه Dong.9 یک پرفیوژن پاروتید سازگار بود سی تی اسکن یک راه آسان برای بررسی ضایعات پاروتید است زیرا آن را انجام می دهد تحت تأثیر مصنوعات حرکتی قرار نمی گیرد. دندان مصنوعی و همچنین حرکات حنجره در موقعیت پایین برخی از پاروتید
توده ها می توانند مصنوعات ایجاد کنند. بیماران نیاز به برداشتن دندان مصنوعی دارند و از بلعیدن در طول سی تی اسکن پرفیوژن خودداری کنید تفاوت آماری معنی داری در توزیع جنسیتی بود تومورهای بدخیم و خوش خیم، با p-value<0.01، و تومورهای بدخیم در زنان بیشتر از در مردان بیشتر تومورهای خوش خیم در مردان دیده می شود. در حالی که این پارامتر در مطالعات دیگر اندازه گیری نشده است. ارتباط معنی داری بین خوش خیم و تومورهای بدخیم پاروتید با افزایش سن (p-value¼0.36). هنگامی که ما TDC ها را ارزیابی کردیم، متوجه شدیم که بیماران با WT نرخ بالایی از افزایش سریع در الگوی WR داشت که مشابه یافته های دونگ و همکاران 9 TDCهای صعودی بود و فلات نوع 4 در PA شایع تر بود. در این مطالعه، TDC نوع 1 و نوع 4 در هیپوواسکولار شایع تر بود توده های خوش خیم و منحنی نوع 2 در خوش خیم هیپرواسکولار توده ها، و بیشتر نوع 4 و نوع 3 در آن دیده شد گروه بدخیم با توجه به تجزیه و تحلیل آماری، این همبستگی معنی دار بود. بر اساس داده های جی مطالعه وانگ، الگوهای TDCs همبستگی معنیداری داشتند در میان سه گروه همچنین، BV، BF، و MIP در خوش خیم WT به طور قابل توجهی بالاتر از آدنوم پلئومورفیک بود
جدول 2 مناطق زیر منحنی متغیرهای مختلف در تجزیه و تحلیل ویژگی های عملکرد گیرنده برای افتراق بدخیم از پاتولوژی های خوش خیم.
جدول 3 نقاط برش انتخابی و شاخص های تشخیصی آنها برای افتراق ضایعات بدخیم از خوش خیم برای بهترین متغیرها
که همان نتیجه ای است که وانگ در مطالعه خود یافت. 2 TDC به تمایز بین هیپرواسکولار خوش خیم کمک می کند و توده های هیپوواسکولار بدخیم. حضور الف شبکه مویرگی غنی و تعداد زیادی رگ خونی با دیوارهای ضعیف در این گروه از توده ها، به ویژه در موارد WT، می تواند این الگو را توجیه کند. بیشتر بدخیم ها توده ها دارای منحنی نوع 3، و همچنین اکثر هیپوواسکولار بودند توده های منحنی نوع 4; این احتمالا به دلیل کاهش خون است جریان در توده های خوش خیم و دیواره های عروقی دست نخورده در اینها توده ها بنابراین، انواع مختلف نمودارهای TDC می توانند منعکس شوندمیکروسیرکولاسیون در توده های پاروتید و کمک به تشخیص
شکل 2 منحنی مشخصه عملکرد گیرنده با حداکثر شدت پروجکشن (MIP) برای افتراق تومور وارتین (WT) از دو آسیب شناسی دیگر
جدول 4 نقاط برش انتخابی و شاخص های تشخیصی آنها برای افتراق تومور Warthin از ضایعات بدخیم و آدنوم پلئومورفیک بر اساس میانگین پیش بینی حداکثر شدت
شکل 3 منحنی مشخصه عملکرد گیرنده با حداکثر شدت طرح ریزی (MIP) انحراف استاندارد (SD)، میانگین MIP توسطMIP SD، زمان به پیک (TTP) و زمان منحنی 2 برای افتراق ضایعات بدخیم پس از حذف ضایعات با میانگین MIP 116
و توده WT از نظر BF، BV و MIP معنی دار بود در تمام پارامترها (p-value 0.001). مشاهده بیماران با WT با توجه به ویژگی های این قابل قبول است نوع تومور، اما PA ممکن است بدخیم شود برای انتخاب نوع درمان می توان از سی تی اسکن پرفیوژن استفاده کرد
در توده های پاروتید خوش خیم تفاوت میان WTs و MTs توسط MIP، BV و BF معنیدار بود (001/0p-value) که مشابه نتایج مطالعه توسطWang.10 میانگین کلی BV، BF و MIP برای MT ها بود بالاتر از آن برای PA اما معنی دار نبود همبستگی با تجزیه و تحلیل آماری حضور نواحی متعدد نکروز در ضایعات بدخیم می تواند باشد عامل کاهش پارامترهای CT پرفیوژن.10 بنابراین، MIP، BV و BF که منعکس کننده رگزایی تومورها هستند که تا حدودی از سه گروه قابل تشخیص است. که در در این مطالعه، بالاترین میانگین BF و BV در WTs مشاهده شد. تفاوت معنی داری بین خوش خیم و MT ها از نظر نفوذپذیری. در مطالعه دونگ و همکاران، BV، BF، و PS در PA کمتر از MTs بود. برعکس بود در رابطه با آدنوم سلول بازال صادق است و WT بالاتر بود BV و BF از MTs. نفوذپذیری عروق تومور در آدنوم بازال نیز بیشتر از MTs بود با توجه به تنوع بالای تومورهای خوش خیم پاروتید و الگوهای مختلف پارامترهای سی تی اسکن پرفیوژن، این است روش به عنوان یک روش مقایسه ای مناسب نیست تومورهای خوش خیم و بدخیم پاروتید. از نظر مویرگی نفوذپذیری، سطح نفوذپذیری (PS) و TTP وجود داشت تفاوت آماری معنی داری بین خوش خیم و گروه های بدخیم، گروه WT و گروه PA. PS فاکتور بین WT ها از نظر آماری تفاوت معنی داری نداشت، PAs و MTs، که همچنین مشابه نتایج یافت شده در بود مطالعه توسط Bisdas.7 با این حال، در مطالعه وانگ و همکاران، 15 بین خوش خیم و بدخیم همبستگی مثبت وجود داشت تومورها از نظر PMB، در حالی که در مطالعه توسط Bisdas و همکاران 7 هیچ ارتباط واضحی وجود نداشت که بتوان آن را توجیه کرد با توجه به امکان ناهمگونی در ROI
جدول 5 مناطق زیر منحنی متغیرهای مختلف در تجزیه و تحلیل ویژگی های عملکرد گیرنده برای افتراق بدخیم از پاتولوژی های خوش خیم پس از حذف با حداکثر شدت برجستگی116
جدول 6 نقاط برش انتخابی و شاخص های تشخیصی آنها برای افتراق تومورهای بدخیم از سایر ضایعات خوش خیم پس از حذف ضایعات با حداکثر شدت برجستگی به طور میانگین برابر یا بیشتر از 116 است
جدول 7 شاخص های تشخیصی نوع منحنی برای افتراق تومور Warthin و آدنوم پلئومورفیک
region.7 برای به حداقل رساندن این دام، سعی کردیم یک جامد را انتخاب کنیم ناحیه تومور و همگن ترین ROI به اجتناب از انتخاب مناطق نکروز؛ در همین حال، کاربران ممکن است ترجیح می دهند شکل و اندازه های مختلف ROI تومور را انتخاب کنند برای تعریف، اگرچه توفیق و همکاران هر دو را نشان دادند روش ها (تک بخش با بزرگترین ابعاد تومور یا میانگین چند بخش) قابل قبول است. TTP تفاوت آماری معنی داری را بین PA و MT (p-value¼0.016). زمان اوج در PA بود بالاتر از MTs. با توجه به اینکه فاکتور TTP است بسته به سیستم قلبی عروقی، مناسب نیست فاکتور برای تجزیه و تحلیل سی تی اسکن پرفیوژن بر اساس مطالعات قبلی.4 در مطالعه ای توسط توفیق و همکاران 17، آنها به شدت نشان داد که برای به دست آوردن CT پرفیوژن (CP) پارامترهای تومورهای سر و گردن با استفاده از شریان کاروتید داخلی (ICA)، شریان کاروتید خارجی (ECA)، و ICA طرف مقابل کاملا پذیرفته شده اند؛ اگرچه آنها استفاده از ICA را پیشنهاد کردند به جای ECA برای استانداردسازی و ساده سازی پس پردازش. اگر ICA همان طرف تحت تأثیر ضایعات باشد، طرف مقابل
ICA انتخاب است. به نظر می رسد که BF و BV قابل اعتمادتر هستند عواملی نسبت به PMB و TTP برای مقایسه انواع مختلف تومورهای پاروتید به دلیل وجود اختلاف نظر در مطالعات مختلف منحنی TDC-peak در این مطالعه مورد مقایسه قرار گرفت گروه های مختلف بیماران، بر خلاف سایر مطالعات، و با توجه به این پارامتر از نظر آماری معنی دار است تفاوت بین ضایعات خوش خیم و بدخیم مشاهده شد(p-value¼0.008). تفاوت معنی داری نیز وجود داشت بین WT و توده های بدخیم (p¼0.001). را میانگین این پارامتر برای ضایعات خوش خیم هیپوواسکولار 35.9 بود که ممکن است به دلیل زمان مورد نیاز برای خوش خیم بودن باشد توده ها به سمت قله و همچنین بالاتر افزایش می یابد نفوذپذیری در بافت پوششی ضایعات بدخیم، که اجازه ارتفاع بالاتر به سمت قله را نمی دهد. سایر تکنیک های تصویربرداری انتشار، مانند تک نمایی، حرکت غیر منسجم داخل ووکسل دو نمایی (ریز عروقی)، تصویربرداری کشیدگی انتشار (اینتراوکسل ناهمگونی)، تصویربرداری تانسور انتشار (ناهمسانگردی)، و برای ارزیابی بزاق، تراکتوگرافی تانسور انتشاری در دسترس است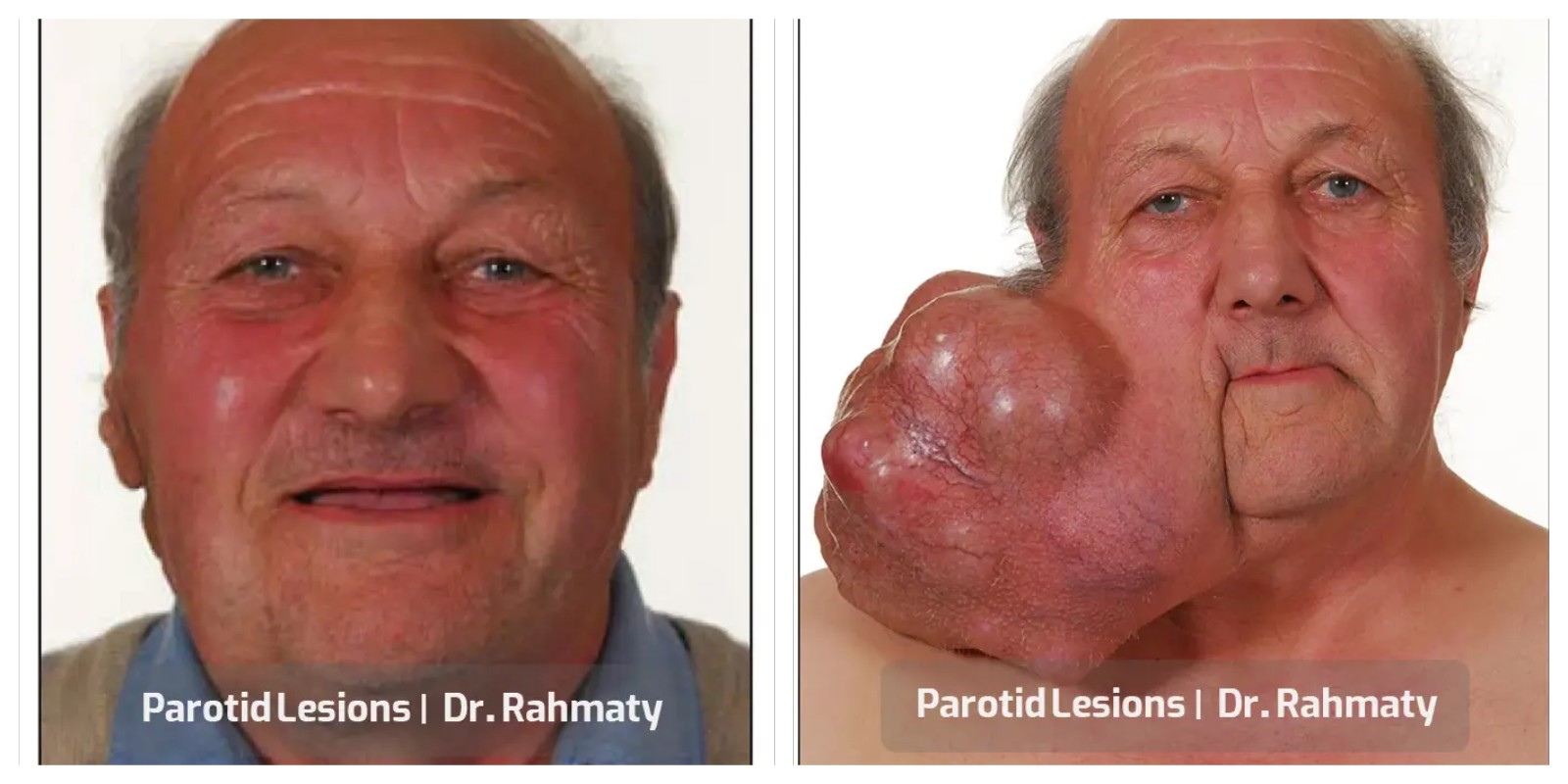
غدد با تعداد زیادی پارامتر؛ این ام آر آی روش ها ممکن است ضایعات بدخیم را از خوش خیم افتراق دهند و در ارزیابی بیماران بعد از جراحی نقش دارند رادیوتراپی و سیالادنیت ناشی از ید و همچنین در تشخیص زودهنگام و مرحله بندی سندرم شوگرن. با توجه به در دسترس بودن سی تی اسکن و همچنین آماری ارتباط بین انواع مختلف پاروتید ایجاد شدضایعات، قیمت متوسط سی تی اسکن در مقایسه با ام آر آی، سی تی اسکن پرفیوژن ممکن است به عنوان یک تشخیص در نظر گرفته شود روش ارزیابی تومور باقیمانده، متاستاز دهانه رحم، و پاسخ درمانی افرادی که از نظر پزشکی به خطر افتاده اند بیماران. محدودیت های مطالعه اول، دوز کلی پرتویی که بیمار را در آن اسکن می کند سی تی پرفیوژن بیشتر از سی تی اسکن معمولی است، که احتمالاً توسط CT با انرژی دوگانه به کمترین دوز کاهش می یابد
اسکنرها و روش های بازسازی که بالاتر نبودند نسبت به دوزهای استاندارد ثانیا، محدوده 3 تا 5 میلی متر مربع بود به دلیل استفاده از 16 برش برای ارزیابی پارامترها استفاده می شود سی تی اسکنر.
 غدد پاروتید سطحی هستند. بزرگترین تومورقطر برای ارزیابی استفاده شد. سوم، طبقه بندی تومورهای بدخیم و بررسی خصوصیات هر گروه به دلیل تعداد کم امکان پذیر نبود نمونه ها. به طور کلی، نتایج سی تی اسکن پرفیوژن می تواند کمک کننده باشد شناسایی انواع مختلف ضایعات پاروتید با این حال، بیشتر بررسی با نمونه های بیشتری برای تثبیت مورد نیاز است اطلاعات موجود نتیجه بر اساس این مطالعه، پارامترهای سی تی اسکن پرفیوژن می تواند بین WT، PA و MT تفاوت قائل شوید. در نتیجه از تکنیک های تصویربرداری اصلاح شده در سال های اخیر مورد توجه قرار گرفته است به استراتژی های مورد استفاده برای تشخیص پاروتید پرداخته شده استmasses.18 بر اساس انواع مختلف مقالات، پرفیوژن از سی تی اسکن می توان برای افتراق خوش خیم از بدخیم استفاده کرد parotidmasses.4،7،9 سی تی اسکن پرفیوژن یک تصویربرداری عملکردی است تکنیکی که برای تعیین عروق تومور استفاده می شود. تومورهای با BF بالاتر به رادیوتراپی حساس تر هستند. و همچنین خطر آسیب بیشتری به سلول های ناشی از رادیکال های آزاد.14 علاوه بر این، سی تی پرفیوژن می تواند برای ارزیابی پاسخ به رادیوتراپی.14،19،20 جریان خون و پارامترهای PMB مستقیماً با کنترل موضعی تومور مرتبط هستند با توجه به مطالعات مختلف، پارامترهای سی تی اسکن پرفیوژن همچنین می تواند برای پیش بینی عود تومور به دنبال آن استفاده شود جراحی و رادیوتراپی. 14 پرفیوژن توموگرافی کامپیوتری پارامترها را می توان برای انتخاب بیمار برای جراحی استفاده کرد و رادیوتراپی به دلیل ویژگی های اساسی نامطلوب ضایعات معمولاً با فنوتیپ های تهاجمی همراه هستند. پرفیوژن توموگرافی کامپیوتری مبتنی بر رگ زایی است فعالیت هایی که ممکن است برای تمایز بین آنها مفید باشد بافت های غیر نئوپلاستیک و نئوپلاستیک. بنابراین، سی تی پرفیوژن از پارامترها می توان برای تمایز بین واکنشگرها استفاده کرد غدد لنفاوی و متاستازهای گرهی و همچنین پی بردن به مرحله سرطان. 21،22 پرفیوژن توموگرافی کامپیوتری می تواند تشخیص دهد بافت های طبیعی از نکروز، فیبروتیک و تومور بافت ها بنابراین با توجه به مطالعات به نظر می رسد که استفاده از این روش در تومورهای سر و گردن، مانند تومورهای پاروتید، می تواند تشخیص و درمان را بهبود بخشد بیماران.
غدد پاروتید سطحی هستند. بزرگترین تومورقطر برای ارزیابی استفاده شد. سوم، طبقه بندی تومورهای بدخیم و بررسی خصوصیات هر گروه به دلیل تعداد کم امکان پذیر نبود نمونه ها. به طور کلی، نتایج سی تی اسکن پرفیوژن می تواند کمک کننده باشد شناسایی انواع مختلف ضایعات پاروتید با این حال، بیشتر بررسی با نمونه های بیشتری برای تثبیت مورد نیاز است اطلاعات موجود نتیجه بر اساس این مطالعه، پارامترهای سی تی اسکن پرفیوژن می تواند بین WT، PA و MT تفاوت قائل شوید. در نتیجه از تکنیک های تصویربرداری اصلاح شده در سال های اخیر مورد توجه قرار گرفته است به استراتژی های مورد استفاده برای تشخیص پاروتید پرداخته شده استmasses.18 بر اساس انواع مختلف مقالات، پرفیوژن از سی تی اسکن می توان برای افتراق خوش خیم از بدخیم استفاده کرد parotidmasses.4،7،9 سی تی اسکن پرفیوژن یک تصویربرداری عملکردی است تکنیکی که برای تعیین عروق تومور استفاده می شود. تومورهای با BF بالاتر به رادیوتراپی حساس تر هستند. و همچنین خطر آسیب بیشتری به سلول های ناشی از رادیکال های آزاد.14 علاوه بر این، سی تی پرفیوژن می تواند برای ارزیابی پاسخ به رادیوتراپی.14،19،20 جریان خون و پارامترهای PMB مستقیماً با کنترل موضعی تومور مرتبط هستند با توجه به مطالعات مختلف، پارامترهای سی تی اسکن پرفیوژن همچنین می تواند برای پیش بینی عود تومور به دنبال آن استفاده شود جراحی و رادیوتراپی. 14 پرفیوژن توموگرافی کامپیوتری پارامترها را می توان برای انتخاب بیمار برای جراحی استفاده کرد و رادیوتراپی به دلیل ویژگی های اساسی نامطلوب ضایعات معمولاً با فنوتیپ های تهاجمی همراه هستند. پرفیوژن توموگرافی کامپیوتری مبتنی بر رگ زایی است فعالیت هایی که ممکن است برای تمایز بین آنها مفید باشد بافت های غیر نئوپلاستیک و نئوپلاستیک. بنابراین، سی تی پرفیوژن از پارامترها می توان برای تمایز بین واکنشگرها استفاده کرد غدد لنفاوی و متاستازهای گرهی و همچنین پی بردن به مرحله سرطان. 21،22 پرفیوژن توموگرافی کامپیوتری می تواند تشخیص دهد بافت های طبیعی از نکروز، فیبروتیک و تومور بافت ها بنابراین با توجه به مطالعات به نظر می رسد که استفاده از این روش در تومورهای سر و گردن، مانند تومورهای پاروتید، می تواند تشخیص و درمان را بهبود بخشد بیماران.
تضاد علایق نویسندگان هیچ تضاد منافعی برای اعلام ندارند.
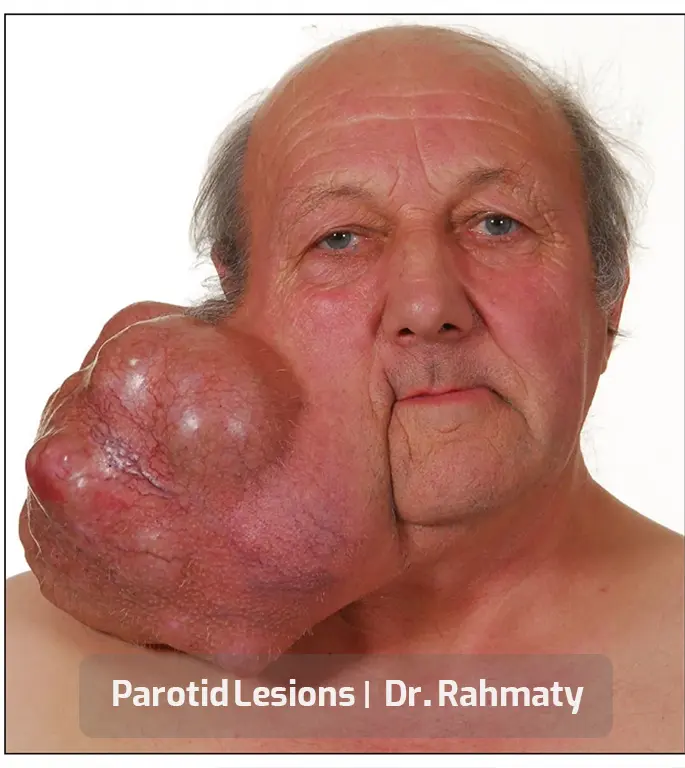
متخصصان زیادی در حوزه عمل تومور پاروتید مشغول هستند اما همه آنها سابقه و تجربه خوبی کسب نکردهاند. یکی از بهترین و متخصصترین جراحان، دکتر رحمتی متخصص گوش، حلق و بینی است که در جراحی سر و گردن نیز موفقیتهای زیادی دارد. این پزشک حاذق در حوزه رینوپلاستی و انواع عملهای بینی تبحر و تجربه خوبی کسب کرده است.




